Academic Exchange | Factors and Evaluation Approach for Immunogenicity Risk Assessment
简介
免疫原性风险评估是生物制品在产品开发阶段重要的组成部分,也是整体临床获益风险评估的一部分,它要求在临床研究阶段对受试者的免疫原性进行监测和分析,有助于确保最合适的候选产品进入临床研究。免疫原性风险评估包括产生免疫反应本身的风险因子评估以及发生免疫反应后对临床后果的影响的评估。后者对总体获益风险的评估尤为重要,并可能决定免疫原性风险的可接受程度。生物制品的免疫反应关系到产品的有效性和安全性,对于安全性的评估,要分析免疫相关的不良事件,包括考察抗药抗体的产生、过敏反应、细胞因子释放综合征、介导内源性蛋白的交叉中和反应等,这些反应可能导致某个生物制品开发的提前终止。由于生物制品引起的免疫反应以体液免疫反应为主,因此针对生物制品的抗药抗体分析一直是衡量此类产品免疫原性的主要标准。进行风险评估所需的信息范围因产品类型而异,产品相关因素、受试者相关因素、治疗相关因素都是产品的免疫原性风险因素,这些因素归纳在表1中,并且在后面的章节中详细论述。在生物制品开发的早期阶段应考虑这些免疫反应的性质和风险因素,并实施可能的解决办法。免疫原性导致的临床后果可能差异很大,接受生物制品后受试者的反应通常也难以准确预测,因此,即使最初的风险评估结果的表明该产品的免疫原性风险较低,也应谨慎考量源于此治疗产品的临床反应事件。在生物制品的开发过程中,阐明免疫原性相关不良事件的机制可以尽早制定风险控制策略。
表1 免疫原性风险因素
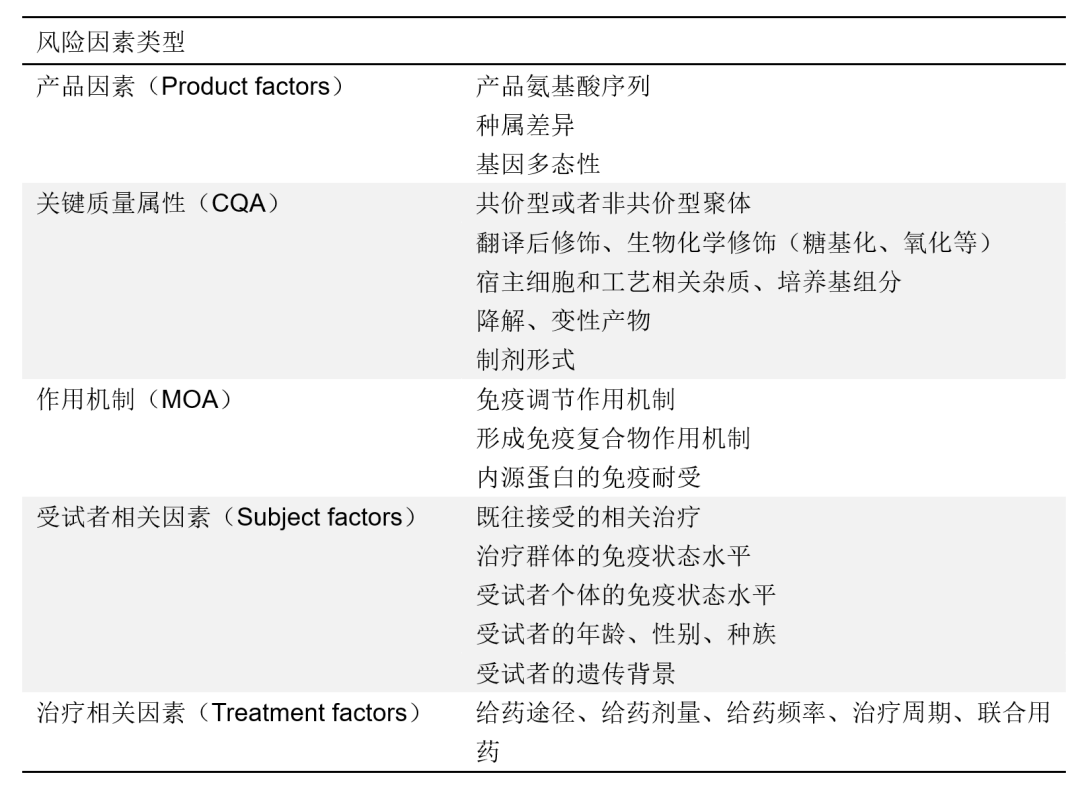
免疫原性风险因素
氨基酸序列
对于生物制品产生免疫原性风险的主要驱动因素之一是氨基酸序列和T细胞表位的含量。任何经工程化改造以改变天然氨基酸序列的生物制品,均可能引入新的免疫识别表位,例如在生物制品中经序列改造引入的氨基酸位点突变、异源物种的氨基酸序列、两种蛋白的氨基酸序列拼接区域、非天然或经生化修饰的氨基酸,这些都可能成为免疫识别的新位点而增加免疫反应发生的风险。绝大多数生物治疗产品在氨基酸序列上的设计和优化,均可能非预期地增加产品属性的氨基酸序列相关免疫原性风险因素,应采取合适的生物分析方法进行全面的评估。
种属间
对于异源的生物制品通常具有可预期的免疫原性反应,种属间的表位差异主要来源于种属间氨基酸序列的不同,这类种属间差异比较容易被机体识别,是非常重要的风险因素之一。例如,在抗体治疗产品中,鼠源抗体能够在人体内引发强烈的免疫反应,因此随着抗体工程技术的进步,将鼠源恒定区序列更替为人源恒定区序列形成嵌合抗体,减少了部分免疫原性反应的发生。然而,鼠源抗体的可变区仍然可以被免疫系统识别并产生相应的抗药抗体,抗体人源化技术将可变区中较为恒定的框架结构区域的氨基酸序列替换为人源序列,进一步减少免疫原性风险。不过,人源化抗体的体外亲和力成熟过程可能产生新的独特型表位。目前,获批最多的抗体骨架类型已从人源化抗体发展至全人源抗体,其氨基酸序列全部来源于人源,将免疫原性风险降至最低。生物制品种属间差异是生物制品开发者首先要考虑到的免疫原性风险因素,应谨慎设计产品的种属来源,降低可预期的免疫原性风险。
基因多态性
在临床研究中,受试者间也存在天然的基因多态性,不同受试者间所携带的基因型可能不同,进而导致表达的内源蛋白氨基酸序列也不同,并由此产生的表位差将引起的免疫原性。通常可认为基因多态性是免疫排斥的主要来源,不同亚型间可能存在单个或几个氨基酸序列的差异,将导致受试者与受试者间、受试者与人源的生物制品间发生交叉的免疫反应。
关键质量属性(CQA)
关键质量属性指产品具备的直接或间接影响安全、鉴别、强度、纯度的物理、化学、生物方面的特性,其确定的标准是基于产品在不符合该质量属性时对受试者安全性和有效性所造成危害的严重程度。因此,关键质量属性相关风险因素是生物制品免疫原性风险评估中常常要考虑的一项重要内容,主要包括共价型或者非共价型聚体、翻译后修饰(如糖基化、磷酸化、氧化修饰等)、宿主细胞和工艺相关杂质(如宿主细胞的外源蛋白、DNA、内毒素、培养基成分等)、降解产物(如铰链区的化学断裂、二硫键的还原、蛋白酶的水解作用等)、制剂形式等。相较于传统单克隆抗体和重组蛋白的生物制品,功能更为复杂的新型生物制品可能具有更高的关键质量属性相关的免疫原性风险,如双/多特异性抗体可能含有更多非天然的功能域和结构域排列,将导致更高的聚体相关免疫原性风险;抗体偶联药物(ADC)产品通过偶联作用将连接子和小分子毒素连接到抗体骨架上,额外的分子结构修饰以及抗体分子不同的抗体偶联比(DAR)值也将引起额外的免疫原性风险。
糖基化/聚乙二醇化
糖基化可能对生物制品的免疫原性有较大的影响,一些外源糖类、不同糖型可能引发严重的先天性或适应性免疫反应。生物制品的糖基化通常可以增强其溶解性和减少产品聚体的发生,也可以屏蔽免疫原性表位避免免疫系统识别,间接影响生物制品的免疫原性。因此,尽可能使用人源的细胞系表达生产生物制品,以便最大程度地产生近似内源性糖基化修饰的蛋白产品。此外,生物制品的聚乙二醇(PEG)化可通过类似的机制降低其免疫原性,另一方面,聚乙二醇本身也可能引起免疫反应并导致产品疗效丧失和不利的安全后果,抗聚乙二醇的抗体在聚乙二醇化的生物制品间具有交叉反应性。
生产工艺杂质
所有生物制品均应评估产品所有附带成分(包括蛋白和非蛋白成分)的含量和免疫反应性,应对此类生产工艺和产品相关杂质的潜在免疫反应进行风险评估,根据生物制品以及所有生产工艺和产品相关的附带成分与对应人类的内源蛋白同源性情况,评估同源性低免疫原性高的分析物并设计分析方法。尽量明确生物制品在生产中由各类微生物、宿主细胞产生的相关杂质,减少杂质类型和数量对于免疫原性风险控制尤为重要。
制剂成分
制剂成分主要用于生物制品在储存过程中天然构象的保持,通过阻止疏水作用引起的聚集和变形、防止生化反应导致的降解(如蛋白酶水解截断、氧化还原、脱氨基等)。生物大分子辅料如人血清白蛋白(HSA)可以减弱疏水相互作用,但在非理想的储存条件下可能与生物制品形成聚集体,对免疫原性产生一定的影响。聚山梨醇酯是人血清白蛋白常用的制剂替代品,当它们发生氧化修饰时也可能对生物制品的完整性构成威胁。此外,物制品的储存容器也可能产生浸出物,例如一项临床前研究发现,容器封口橡胶瓶塞的浸出物(有机化合物和金属离子)由含有聚山梨醇酯的制剂溶液中洗脱出来,导致了氧化和聚集。
作用机制(MOA)
免疫调节
随着以免疫调节为治疗方式的生物制品上市和相关临床研究经验的累积,基于免疫调节作用机制的免疫原性风险因素已逐渐成为研究者要考虑的因素之一。生物制品的作用机制如果涉及免疫检查点抑制剂、共刺激分子激动剂、结合T、B淋巴细胞、阻断或增强炎症/免疫相关细胞因子等方式,该产品诱发免疫原性风险的可能性将更高。当nivolumab(“O药”)单用时,11.2%的受试者产生ADA;当它与另一个免疫抑制剂ipilimumab合用时,ADA发生率提高到37.8%。含有免疫抑制剂的双抗可能有类似免疫原性增强的效应。在评估基于作用机制的免疫原性风险因素时,需要考虑生物制品至少一个结构域与免疫细胞的结合能力,当生物制品与靶细胞结合并并发生作用时,可能也会调节免疫细胞相应的生物学功能、产生增强或减弱针对生物制品的免疫反应的效应。例如,结合CD3结构域的生物制品似乎更容易引起抗药抗体(ADA)的发生。可能的原因有(1)对于能够通过CD3激活T细胞的情况下,细胞免疫和体液免疫的反应性由此加强;(2)对于通过CD3仅结合T细胞、但不激活的情况下,生物制品中抗CD3的结构域可能增加了T细胞与识别该产品其它结构域的B细胞之间的侨联,从而加强了生物制品特异性B细胞接受T细胞辅助和抗原的呈递功能。另一些生物制品也可能通过作用机制降低免疫原性风险,例如抗CD19抗体的生物制品在人体内可以耗损CD19+的B细胞,相较于抗实体瘤靶点(如EGFR、HER2等)的抗体产品,免疫原性发生率更低。
免疫复合物
另一方面,基于形成免疫复合物作用机制的免疫原性风险因素也是需要考虑的因素之一。生物制品(包含单体、多聚体形式)与游离的或解离的靶点蛋白能够在机体内形成抗原抗体免疫复合物;而抗体的Fc段结构域(含有CDC、ADCC效应功能的相关受体、FcRn相关受体等)或膜靶点结合的结构域也能促进细胞表面免疫复合物的形成和复杂化,具有很高的免疫原性风险。因此,与能形成免疫复合物的生物制品相比,不易形成免疫复合物的产品免疫原性风险可能更低。对于双/多特异性生物制品,由于一个分子具有多个特异性靶点结合的结构域,它们更容易形成免疫复合物。为了评估相关风险,应在临床前和早期临床研究阶段开展针对免疫复合物的形成能力、水平、结合比例、发生时间以及存续周期等分析。
免疫耐受
人体对内源蛋白的免疫耐受程度是不相同的,内源蛋白的免疫耐受程度将影响重组蛋白、基因治疗等产品的免疫原性风险,当接受此类生物制品治疗时可能打破机体原有的免疫耐受。细胞免疫和体液免疫的免疫耐受性取决于许多因素,其中内源蛋白的丰度是重要的因素之一:较低丰度的内源蛋白(例如血清水平可能含量仅在ng/mL、甚至pg/mL水平的细胞因子)的免疫耐受性相对较弱,反之高丰度或高表达的内源蛋白耐受性则更高。通过外源重组蛋白、基因治疗表达产物(外源蛋白)等产品的治疗,在短时间内蛋白水平可能有显著的跃迁,高水平表达的低丰度蛋白将打破免疫系统对内源蛋白的免疫耐受。在这种情况下,需要考量的主要风险因子有:(1)是否首次临床研究;(2)内源蛋白是否具有独特的生理功能;(3)在自身免疫性疾病中可检测到对内源蛋白免疫的反应性等。在临床研究开始前,应对内源蛋白的免疫耐受稳健性进行评估,包括生理稳态下的内源蛋白水平、预存抗体、细胞免疫反应评估、基因突变、以及多态性分析(潜在的交叉反应性)等。
受试者相关因素
既往相关治疗
受试者既往接受的相关治疗是临床研究值得考虑的免疫原性风险因素之一。当受试者在治疗前接受过相关的或结构相似的生物制品,体内可能已经存在针对该类治疗产品的预存抗体,当再次暴露于相关的生物制品时,将增加受试者的免疫原性风险。例如先前暴露于重组蛋白治疗的受试者对再次接受(表达相应蛋白的)基因修饰干细胞治疗时,免疫原性风险将会增加;经抗HER-2单克隆抗体治疗的患者,再次接受相同抗体骨架的ADC产品时,免疫原性风险也会增加。由于无法收集受试者所有可能存在预存抗体的治疗史,在临床研究时应考虑筛查预存抗体,例如AAV类基因治疗产品在受试者入组前,通常先进行抗AAV总抗体或中和抗体的评估。
免疫状态
受试者的免疫状态包括治疗群体的水平和受试者个体的水平,治疗群体所涉及的不同类型适应症可能具有不同程度的免疫状态,例如自身免疫疾病、淋巴瘤、感染类疾病等。与免疫受限的受试者相比,免疫激活的受试者可能产生更强的免疫反应性。据报道,具有免疫能力的癌症受试者有95%对GM-CSF治疗产品产生了中和抗体,而免疫受损的受试者只有10%产生了免疫反应。受试者个体的发生免疫反应的能力可能因既往接受过免疫相关的治疗而改变,例如接受过甲氨蝶呤化疗、免疫检查点抑制剂(PD-1、PD-L1抗体治疗)等受试者在联合治疗时可能对免疫原性产生显著的影响。此外,受试者的年龄也可能影响免疫状态,尤其是处于年龄两端的群体,年龄较高的受试者可能普遍免疫能力低下,而年轻的受试者则具有更良好的免疫能力。
遗传背景
受试者的遗传背景也可以影响生物制品的免疫反应,在部分接受治疗的受试者失去临床获益或经历严重不良事件的情况下,建议评估免疫反应的遗传因素。基因组表型为HLA单倍型的受试者对特定治疗产品可能产生不良抗体反应,HLA基因谱的检测有助于受试者群体的子集风险评估,例如针对IFN-γ治疗产品产生中和抗体的受试者可能具有不同的HLA单倍型,了解具有此类HLA单倍型受试者对免疫反应的敏感性,将可以采取有效的预防措施或采用替代的治疗方案。
受试者群体
在开发生物制品时,应提供证据支持临床研究已选择了适当受试者人群,尤其是首次人体研究。在所有治疗过程中都应考虑并纳入生物制品对抗药抗体发生发展的潜在影响。与受试者相关的风险因素可能增加或减少潜在的免疫反应风险,因此建议当临床研究从一类受试者群体更换到另一类受试者群体时要谨慎考量,并且对每一个进入临床研究的受试者个体进行新的风险评估,以确保最低的风险评估结果。
治疗相关因素
治疗方案相关的免疫原性风险因素包括给药途径、给药剂量、给药频率、治疗周期、联合用药等,免疫反应程度取决于临床试验方案中生物制品特性和受试者两方面因素的复杂相互作用。通常认为皮下注射相比静脉注射和肌肉注射的免疫原性风险更高,这可能是由于皮下组织环境中存在更多的抗原呈递细胞,局部高浓度小体积的给药方式将引发对生物制品的摄取、加工和呈递更有效率,诱导产生了更强的免疫反应。而更大的给药剂量、更密集的给药频率和较长的治疗周期均增加生物制品的免疫原性风险。值得注意的是,虽然这些风险因素在临床试验方案设计时就已经确定,但在可控且预期的安全范围内,应兼顾临床研究的有效性。
免疫原性分析方法
许多生物制品的免疫原性分析方法是相似的,不过新型的药物形式需要考虑新的结构对免疫原性的影响程度,生物分析方法复杂性的增加将需要研究者建立适用的检测方法,以进行评估免疫原性风险的结果。
抗药抗体(ADA)分析
通常,生物制品的ADA分析采用分层级免疫原性分析策略(筛选、确证、表征、滴度)。用于ADA筛选的检测方法可以初步分析受试者的抗药抗体情况,并进一步判断是否进行确证分析。给药途径和部位会影响ADA的抗体亚型种类,表征的检测方法需要针对性的考虑,血液样本应能够检测IgG和IgM亚型、来自肠道或肺部的样本则可能需要建立IgA的检测方法。血液样本的抗药抗体检测方法已相对成熟,经优化的灵敏度、准确度、特异性的配体结合方法(LBA)可以快速建立并应用到临床前和临床试验的评估中。此外,当生物制品引发不良的过敏反应时,建议考虑IgE亚型的评估。
中和抗体(NAb)分析
由于中和抗体能够直接干扰并中和生物制品的药效作用,因此中和抗体的生物分析也尤为重要。中和抗体的检测是免疫原性风险评估的一项重要数据,应优先采用基于细胞的检测方法(CBA)进行评估。抗药抗体和中和抗体的生物分析数据均是药物安全性评价的重要数据信息,也是免疫原性风险评估的两种重要的检测方面。
预存抗体分析
一些受试者在接受生物制品治疗前已经存在针对药物的抗体,这些预存抗体可能通过促进清除、阻止靶点结合等方式影响药物的动力学特征、有效性和安全性。例如一些AAV基因治疗产品的临床试验需要在受试者入组前评估预存抗体的情况,这可能包括检测抗药抗体和中和抗体的水平。预存抗体检测结果为阴性的受试者其免疫原性风险评估将较低,而阳性受试者的潜在风险较高,提示研究者是否需要采取治疗前措施或者排除该类受试者。
风险评估实例
对于生物制品的免疫反应临床结果评估,可能从没有明显反应至产生严重的不良反应事件。尽管了解与产品本身、受试者以及治疗方案相关因素的充分信息可以初步评估免疫原性风险,但不能仅根据对这些风险因素的预测结果进行最终的定论,应在实际的临床研究中进行抗药抗体检测和分析,并出具详细的评估报告。生物制品的免疫原性风险评估是一个多方面、多角度的考察过程,完善的风险评估报告有助于为新药临床研究审批(IND)提供足够的风险评估信息,来证明药物在首次进行人体临床试验时具有安全性;以及在新药上市申报(NDA)中提供重要且完整的安全性数据更新报告。完善的风险评估是一个多次重复的过程,首次临床试验之前需要一次评估,有了临床免疫原性的数据后重新调整,至少在关键性临床试验前重新评估一次。如表2所示,一项为靶向可溶性靶点CGRP的人源化抗体mAb-X抗体药在偏头痛病人的临床研究披露了对其试验进行的免疫原性风险评估,其中主要的分析项包括产品因素、治疗因素和受试者因素,如表2所示。综合考虑它是一款靶向游离靶点的人源化抗体,作用机制为拮抗游离靶点,免疫反应风险最初定为中风险,但是在一二期临床试验都未发现严重的免疫反应(ADA阳性率总体低于5%,也未看到免疫相关的副作用),免疫原性风险最终调整为“低风险”。
表2 免疫原性风险评估临床研究实例
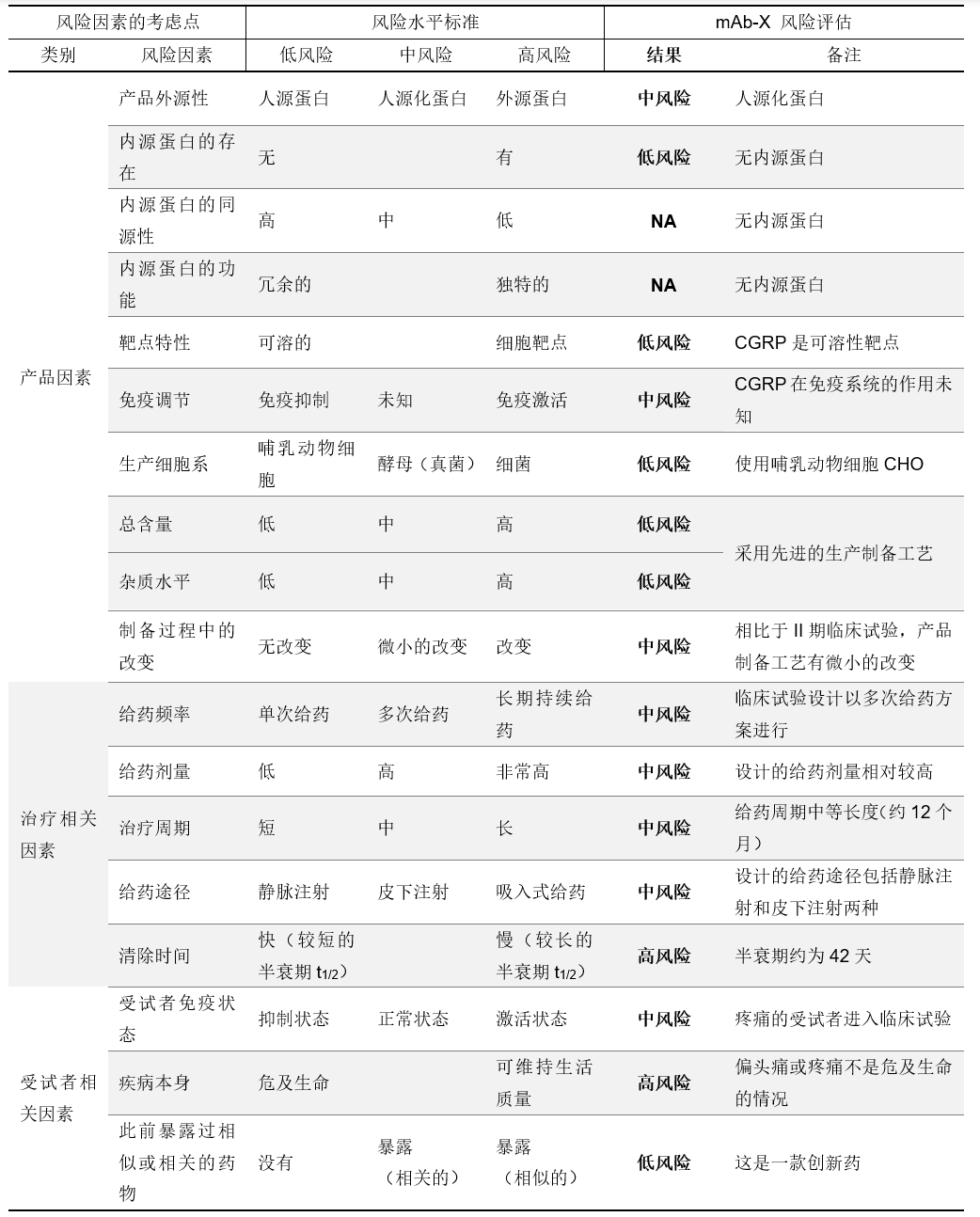
NA: 不适用
参考文献
[1] Mark A Kroenke, Mark N Milton, Seema Kumar, et al. Immunogenicity Risk Assessment for Multi-specific Therapeutics[J]. AAPS J. 2021. 5;23(6): 115.
[2] Johanna R Mora, Joleen T White, Stephen L DeWall. Immunogenicity Risk Assessment for PEGylated Therapeutics[J]. AAPS J. 2020. 28;22(2):35.
[3] FDA. Immunogenicity Assessment for Therapeutic Protein Products [EB/OL]. FDA. 2014.
关于康维讯生物
康维讯生物由经验丰富的生物分析专家团队领衔成立,提供全方位、一站式的生物分析服务,涵盖临床前/临床药代动力学、药效学、免疫原性、生物标志物、生物活性分析、中心实验室样本管理;以及高端分析仪器、高值耗材、试剂的研发销售等业务。公司已建成免疫检测分析平台、分子检测分析平台以及细胞学分析平台等技术平台,并在温州设有高端分析仪器、高值耗材和试剂的CRI研发中心,在苏州吴中生物医药产业园设有3,000平米GLP检测服务实验室,包括适合CGT和ADC产品生物分析的十万级净化实验室,BSL-2级实验室,PCR分析实验室,配备生物分析专业管理系统和高端/专业检测仪器,实验室GLP质量体系可同时满足全球监管机构的申报要求。
康维讯生物团队累积了多年的生物分析经验,将坚持“推动生物行业发展,助力新药研发”的使命,以助力创新型药物上市为己任,致力于成为全球药企生物分析最值得信赖的合作伙伴。康维讯生物以创新技术为基石,一方面提供质高价优、符合全球监管机构要求的生物分析服务,助力药物研发企业降低研发成本,提高申报成功率,加速申报进程;另一方面研发并提供高端分析仪器和高值耗材试剂产品,助力分析行业构建低成本的产业链生态,并进一步打造高度自动化、高灵敏度的分析检测能力。康维讯生物已经开发出助力生物分析实验室自动化的板式自动化操作平台和支持细胞治疗产品研发的细胞分选仪。康维讯生物肩负两大业务版图为双轮驱动,以塑造成生物分析CRO领域的国际化品牌与形象。 2023年,康维讯生物已荣获:第四届国际细胞与基因治疗中国峰会最具潜力的CGT CRO TOP10;中国生物医药产业价值榜最佳服务供应商TOP10;第五届生物药开发者创新大会年度最优品质服务奖;第五届亚洲生物制药创新峰会最具潜力的ADC与双抗药物生物分析CRO TOP10。 更多信息,请访问康维讯生物官方网站:
www.kanwhish.com
Please tell us your questions or needs
and Kanwhish Biotech will contact you as soon as possible via email or phone.

 © 2022-2025 Copyright All Rights Reserved. 苏ICP备2023013734号-1
© 2022-2025 Copyright All Rights Reserved. 苏ICP备2023013734号-1