Bioanalytic Strategy for CGT Products: qPCR/ddPCR Assay Development and Validation
qPCR/ddPCR方法学开发验证
随着细胞基因治疗(CGT)的蓬勃发展,目前全球已有几十款CGT产品陆续获批上市,与之相匹配的,qPCR/ddPCR技术在受监管的生物分析中应用也越来越频繁,更多的CRO公司正在不断承接来自申办方临床试验的生物分析工作,同步需要进行方法学开发和验证。定量PCR和数字PCR(qPCR/ddPCR)法是一种可重复性、灵敏度高、可标准化的核酸序列(基因)定量检测技术,广泛用于CGT产品的生物分析中,例如AAV基因治疗对病毒暴露、分布与脱落的检测,CAR-T细胞基因治疗产品的药代(细胞)动力学分析等。在早期临床前研究和IND研究中,通过建立目的基因的拷贝数定量的方法来进行分析,目前对于qPCR的监管与指南尚不完善,而新一代ddPCR技术则几乎缺乏明确的国家指南。2022年GCC(Global CRO Council)发布的白皮书提供相关共识与推荐,以支持PCR检测技术在不同验证项参数的共识、统一验证方法、以及标准操作程序(SOP)。
在qPCR法的方法学开发和验证中已存在的共识验证项包括:
■ 分析灵敏度(Sensitivity);
■ 特异性(Specificity);
■ 选择性(Selectivity);
■ 准确度(Accuracy);
■ 批内/批间精密度(Intra-/inter-assay precision);
■ 定量下限(Lower limits of quantitation, LLOQ);
■ 定量范围(Range of quantitation)。
此外,部分验证项也可以设计在验证中进行,这包括:
■ 稀释线性(Dilutional linearity);
■ 样本稳定性(Sample stability);
■ 重现性(Reproducibility);
■ 稳健性(Robustness)。
较少作为验证项的有:
■ 平行性(Parallelism);
■ 抑制性(Inhibition);
■ 已测样品再分析
(Incurred sample reproducibility, ISR)。
大部分研究者在开发qPCR/ddPCR方法时是依据目前已发布的白皮书和监管指南,尽管接受标准可能略有不同,例如标准品和质控样品(QCs)的准确度在±30%、PCR效率在90%~110%。部分研究提供了更加详细的qPCR验证标准,对于精密度和准确度,在每个水平的质控样品中应有≥50%的样品,且在全部的质控样品中≥67%的质控样品应满足%CV≤25%(在上下限时≤45% )、%RE为±25%(在上下限时±45% )。质控样品稳定性的接受标准则规定为每份样品重复分析的%CV ≤30%,且等份重复(复孔)检测需>67%。质控样品的%CV也应满足 ≤30%等等。当前最紧迫的问题是方法开发者所采用验证接受标准不统一,这在受监管的生物分析报告中可能带来监管风险。GCC的专家共识可以在qPCR/ddPCR方法开发和验证时提供参考,具体验证项的建议汇总在表1、表2:
表1 GCC推荐的qPCR验证项和接受标准
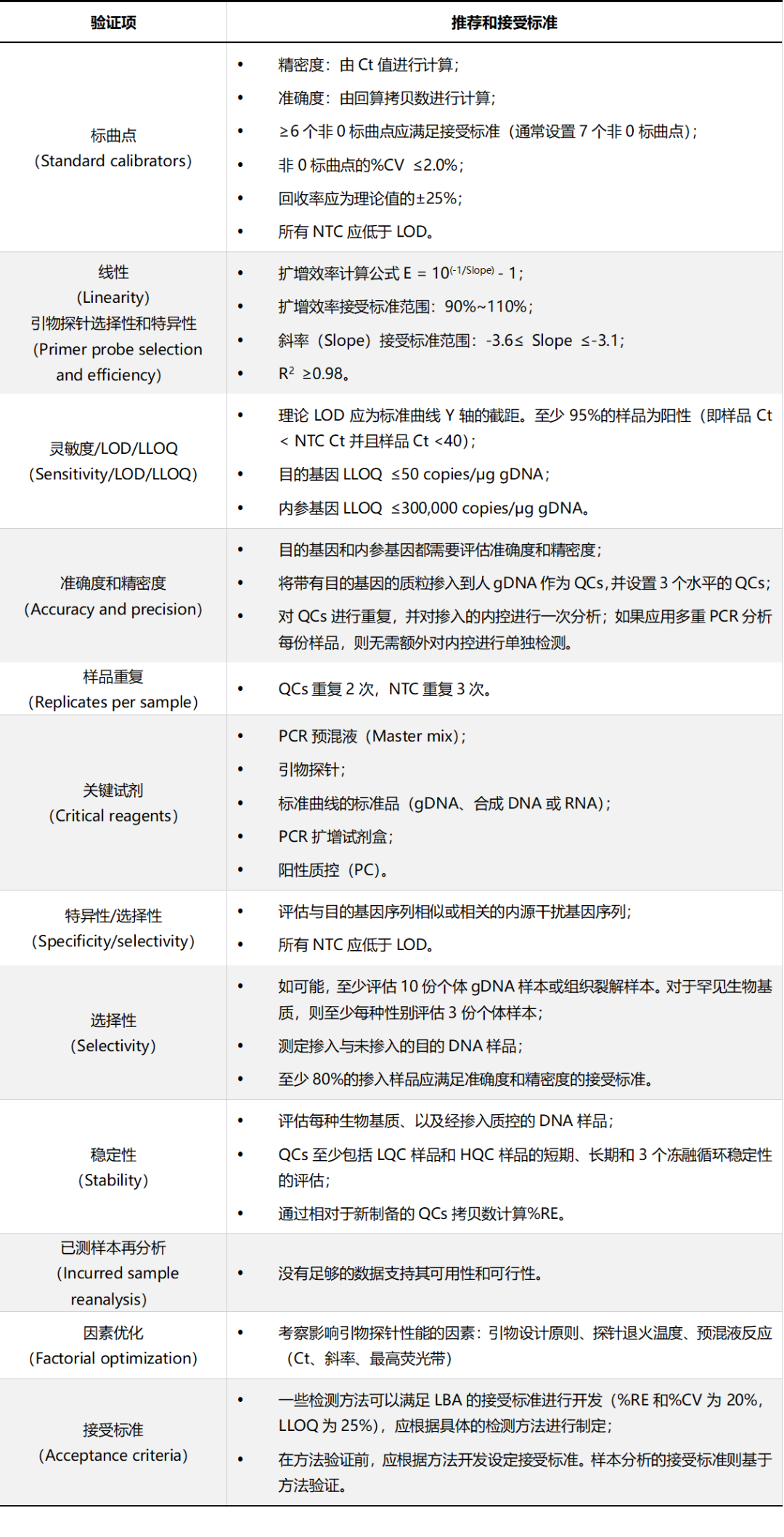
表2 GCC推荐的ddPCR验证项和接受标准
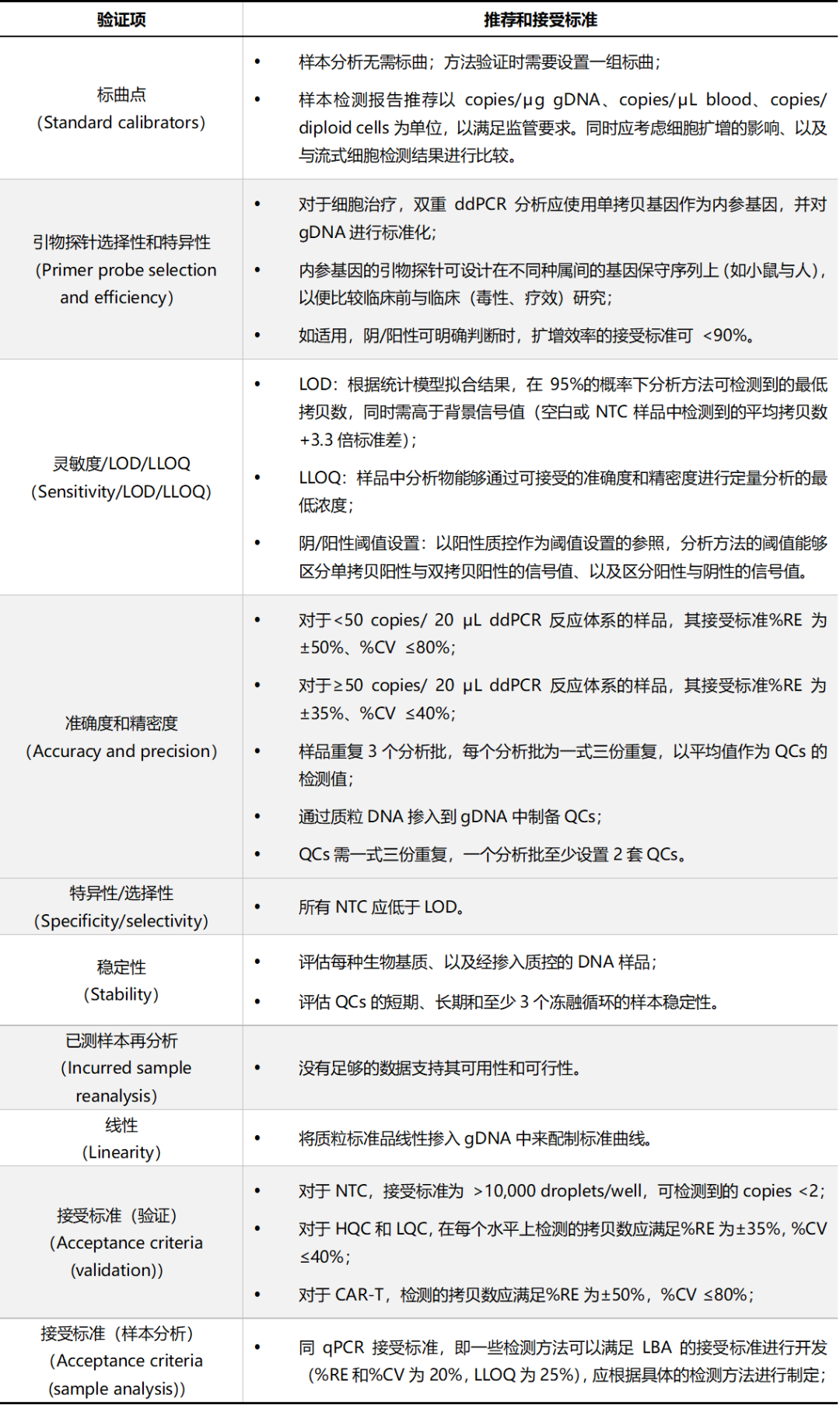
注:Ct:循环数阈值(cycle threshold);ddPCR:数字液滴式PCR(droplet digital polymerase chain reaction);gDNA:基因组DNA(genomic DNA);HQC:高浓度质控样品(high quality control);LBA:配体结合分析(ligand binding assay);LLOQ:定量下限(lower limit of quantitation);LOD:检出限(limit of detection);LQC:低浓度质控样品(low quality control);NTC:无模板对照(no template control);PC:阳性对照(positive controls);QCs:质控样品(quality control samples);qPCR:定量PCR(quantitative polymerase chain reaction);%Bias:偏差(此处等同于相对误差%RE,equal to %RE);%CV:变异系数(coefficient of variation);%RE:相对误差(relative error)。
依据GCC总结出采用PCR技术的分子检测项目宜参考的性能验证参数及方案,在实际的qPCR/ddPCR方法学开发与验证阶段,可进行借鉴。下节将以Kymriah®的方法学验证为例,实例分析qPCR/ddPCR方法学验证的细节与分享。
关于Kymriah®
Kymriah®(通用名Tisagenlecleucel、CTL019、CART19)是全球首款上市的CAR-T免疫细胞基因治疗产品,由诺华公司和宾夕法尼亚大学共同研发。Kymriah®产品在全球主要药品监管机构获批或临床试验进展:
■ 2017年8月获美国FDA批准上市;
■ 2018年8月获欧盟EMA批准上市;
■ 2019年10月获中国NMPA默示许可临床III期试验。
Kymriah®获批的主要适应症包括:
■ 儿童和年轻成人患者(≤25岁)复发或难治性急性淋巴细胞白血病(r/r ALL);
■ 成人患者复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL);
■ 成人患者复发或难治性滤泡性淋巴瘤(r/r FL)
Kymriah®属于经典的第二代CAR-T细胞基因疗法,其CAR结构组成主要含有(图1):
■ 抗原识别域(Antigen recognition domain):
Mus FMC63 anti-CD19 scFv(VL(kappa), LINKER, VH)
■ 间隔域和跨膜结构域(Spacer & transmembrane domain):
CD8α(or CD8,CD8A [pr138~206])
■ 共刺激域(Costimulatory domain):
4-1BB(or CD137,TNFRSF9 [pr214~255])
■ 信号转导域(Signaling domain):
CD3ζ(or CD3Z,CD247 [pr52~164])。

图1 Kymriah® CAR-T结构示意图
Kymriah®治疗机制(MOA)和流程见图2:首先将CAR基因通过转导至受试者自身的T细胞中,经体外扩增、激活后,再将Kymriah®产品回输至受试者体内,CAR-T细胞将在体内快速地进行生物分布,随后经anti-CD19 scFv与靶抗原CD19结合后,4-1BB共刺激域将增强Kymriah®细胞的扩增能力和持久性、而CD3ζ信号转导域则启动T细胞的激活和抗肿瘤活性,进而特异性杀伤CD19+肿瘤细胞。CAR-T细胞可在受试者体内持续增殖和存活,部分受试者在随访数年后仍在外周血和骨髓样本中检出Kymriah®细胞。因此,CAR-T产品的药代(细胞)动力学分析是生物分析领域至关重要的一项临床研究内容。
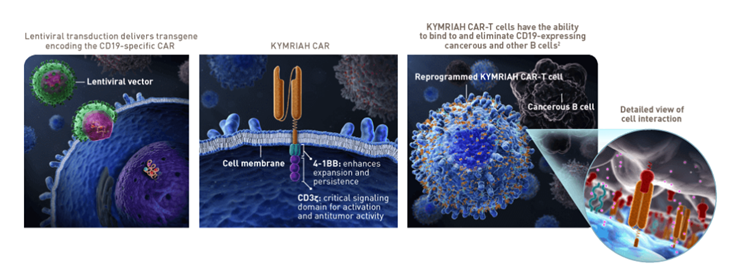
图2 Kymriah®治疗机制和流程
分析CAR-T药代(细胞)动力学特征的关键是选择具有准确定量、高灵敏度的生物分析方法。qPCR法特异性地扩增受试者体内CAR转基因片段的拷贝数,在提供较大动态范围的同时满足高灵敏度和高特异性要求,是评估CAR-T药代(细胞)动力学最为重要的检测方法之一。Kymriah®产品在美国FDA和欧盟EMA获批上市所披露的报告文件中,均应用qPCR法作为药代(细胞)动力学分析的检测方式(表3)。对于该类CGT产品的生物分析方法,将以Kymriah®产品作为实例进行分享,包括设计原理、关键参数、验证性能指标以及接受标准;进一步结合GCC推荐的qPCR/ddPCR方法学验证参数和接受标准,在CAR-T细胞产品的方法开发、方法验证时进行参考。
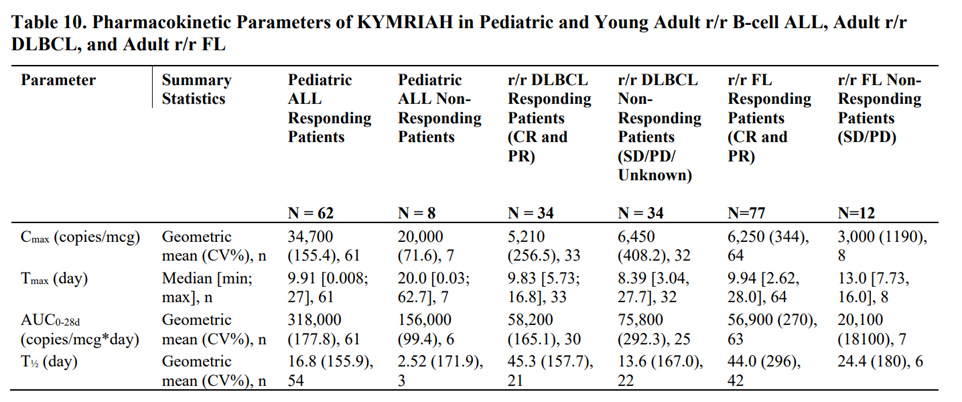
表3 Kymriah®产品在美国FDA获批上市报告所披露的药代(细胞)动力学参数
关键试剂
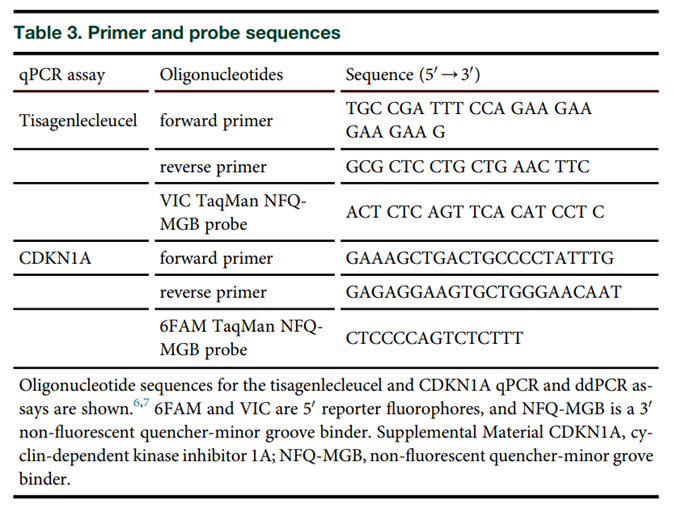
Kymriah®引物探针
应用PCR方法分析CAR-T细胞治疗产品的药代(细胞)动力学特征时,需要已知CAR-T基因的核酸序列,并对该序列设计特异性的引物和探针。以Lisa Davis等研究者报道的文献为例(表4),并通过对公开披露的Kymriah®核酸、蛋白序列进行解析,特异性的Kymriah®引物被设计在两段不同的结构域中,其中正向引物靶向4-1BB共刺激域,反向引物设计在CD3ζ信号转导域;VIC TaqMan NFQ-MGB探针序列则靶向4-1BB与CD3ζ的连接处。
表4 Kymriah®引物和探针序列
值得注意的是,外源且具有高度可变区的scFv域可能是特异性引物探针设计的最佳选择。除scFv靶向识别域外, CAR-T产品的其它结构域通常是人源(Homo sapiens)的基因片段,这样的设计将有可能减少由种属间引起的非预期性免疫原性,降低安全性风险,同时最大限度地激活CAR-T细胞转导信号的功能,以获得最佳的药物效应动力学特征,提高产品疗效,但是这些区域不适合做特异性的引物与探针设计。不过,基于PCR法开发药代(细胞)动力学的分析方法设计时,如果无法得到scFv域的核酸序列信息时,可以考虑scFv域以外的序列进行引物与探针设计产生通用型的方法。由于这些结构域往往是人源的内源基因,通过CAR-T主要结构并结合公共数据库分析各CAR-T结构域的人源蛋白/基因序列信息。在设计引物探针时,人源基因往往存在难以避免的内源基因组干扰,因此优先选择探针法而不是染料法(如SYBR™ Green)以增加方法的特异性。对于非scFv域的引物和探针,正反引物常考虑分别设计在两个相邻且不同的基因片段内,而探针设计在这两个基因片段的连接处(图3,Kanwhish团队支持CGT产品专业的引物探针设计和分析)。

图3 Kymriah®引物探针设计解析(表2)
正向引物设计在4-1BB共刺激域[D5],反向引物设计在CD3ζ信号转导域[D6],特异性探针设计在4-1BB与CD3ζ连接区。aa:氨基酸(amino acid);D:结构域(domain);na: 核酸(nucleic acid);pp:引物探针(primer and probe);pr:蛋白(protein)。
另一方面,在利用qPCR技术测定目的基因拷贝数时,往往不是直接测定目的基因的绝对拷贝数,而是需要设计并分别测定目的基因和内参基因。内参基因的选择也需要谨慎地探究,内参基因是指其表达水平受研究条件的影响较小且可以在目标细胞或样本间恒定存在的已知内源参照基因,通过测定内参基因拷贝数可以准确量化初始样本的载量,并以内参基因拷贝数进行标准化来评估目的基因的相对拷贝数,再进行样品间目的基因拷贝数的比较,内参基因对于PCR法进行目的基因定量时具有重要意义。常作为内参基因有Actin、GAPDH、CDKN1A等。
Kymriah® DNA标准品
qPCR法对临床样品中Kymriah® DNA拷贝数进行定量,采用8点标准曲线(Kymriah®慢病毒质粒掺入健康血样,设置标曲点为0、10、50、100、1,000、10,000、100,000和1,000,000 copies/200 ng gDNA)。标曲点由数字液滴式PCR(ddPCR)进行绝对定量,且与qPCR法的引物探针相同。设置阴性对照(健康血样,不含Kymriah®慢病毒质粒模板,即0 copies/200 ng gDNA)和阳性对照(健康血样掺入1,000 copies/200 ng gDNA)以评估样本污染和定量准确性。每分析批的每个标曲点、阴性质控和阳性质控均一式三份重复,有效批次的接受标准包括标准曲线拟合的斜率与R2值。
内参基因(CDKN1A)DNA标准品
在qPCR法对临床样品中Kymriah® DNA拷贝数进行定量的同时,检测并定量内参基因CDKN1A DNA拷贝数,以校正Qubit荧光定量时对初始DNA的定量误差,并控制DNA定量的变异性。对临床样品中内参基因CDKN1A DNA拷贝数进行定量时采用5点标准曲线(来自健康供者,范围在0.46~25 ng gDNA)。一式三份重复,批次有效性的接受标准与Kymriah® DNA定量接受标准相同,包括标准曲线拟合的斜率与R2,标曲点由数字液滴式PCR(ddPCR)进行绝对定量。
gDNA的理论值与实际检测值之间相比时存在校正因子,该校正因子用于评估Kymriah® DNA拷贝数的计算。检测的结果报告为一定量的gDNA中Kymriah® DNA拷贝数;或一定量的全血或骨髓样品中Kymriah® DNA拷贝数。
方法学验证项
检测限(Limits)
通过对Kymriah® DNA标准品的梯度稀释(0、0.6、1.3、2.5、5、10、25和50 copies/200 ng gDNA)进行qPCR检测来评估空白检测限(Limit of blank,LOB)、检出限(Limit of detection,LOD)和定量下限(Lower limit of quantitation,LLOQ)。对标准品进行梯度稀释,制备成梯度稀释样品(即0、0.6、1.3、2.5、5、10、25和50 copies/200 ng gDNA),重复制备3套梯度稀释样品;每个稀释水平下的各梯度稀释样品均为一式三份重复(即3孔重复),每个分析批共九次重复;进行连续三次分析批检测,每个浓度水平下的标准品共27次重复。以8点标准曲线(0~1,000,000 copies/200 ng gDNA)拟合用于定量梯度稀释标准品的拷贝数,同时计算回收率和精密度。
■ LOB:在0 copies/200 ng gDNA标准品的27个重复检测结果中,40次扩增循环后均未高于Ct阈值信号,LOB确定为0 copies/200 ng gDNA;
■ LOD:通过对标准品的检测结果进行拟合逻辑回归量效曲线(logistic dose-response curve line)(R2=0.9995),在95%置信检出率的情况下,可检出的最低浓度为3.1 copies/200 ng gDNA(图4);
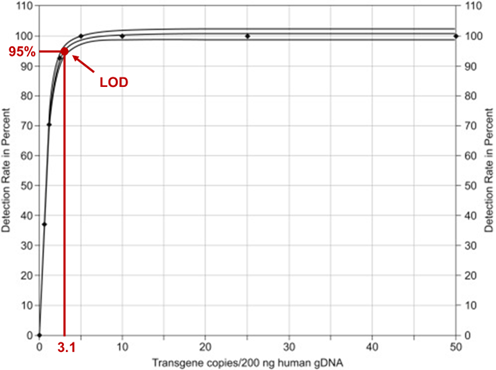
图4 Kymriah®标准品的检出限(LOD)评估
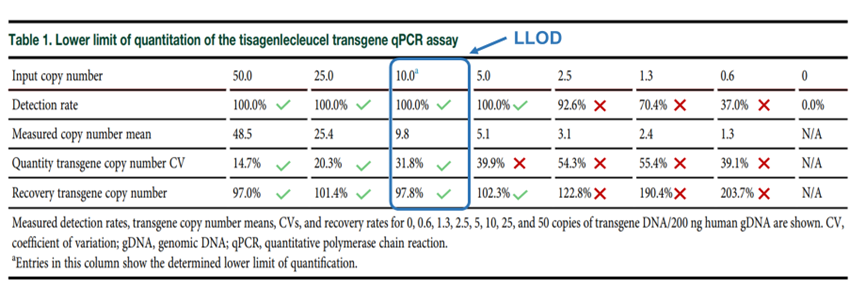
■ LLOQ:当梯度稀释标准品的检测结果满足可接受标准时,即回收率(80.0%~120.0%)、精密度(%CV<35.0%)和检出率(100.0%),该方法的LLOQ被确定为10 copies/200 ng gDNA(表5),这与美国FDA的相关指南(Long Term Follow-Up After Administration of Human Gene Therapy Products,Guidance for Industry. 2022)的要求是一致的(约为50 copies/μg gDNA)。
表5 Kymriah®标准品的定量下限(LLOD)评估
准确度(Accuracy)
对不同含量的CAR转化Jurkat细胞、CAR质粒DNA、健康供者或患者经CAR转化的T细胞掺入到血液或骨髓样本中,共47份样品进行qPCR检测用以评估方法准确度。通过qPCR与ddPCR的检测数据进行双变量线性拟合分析,R2 =0.9980,p <0.0001,表明qPCR与ddPCR检测结果之间具有很高的线性相关性(图5),证明了qPCR结果的准确性。
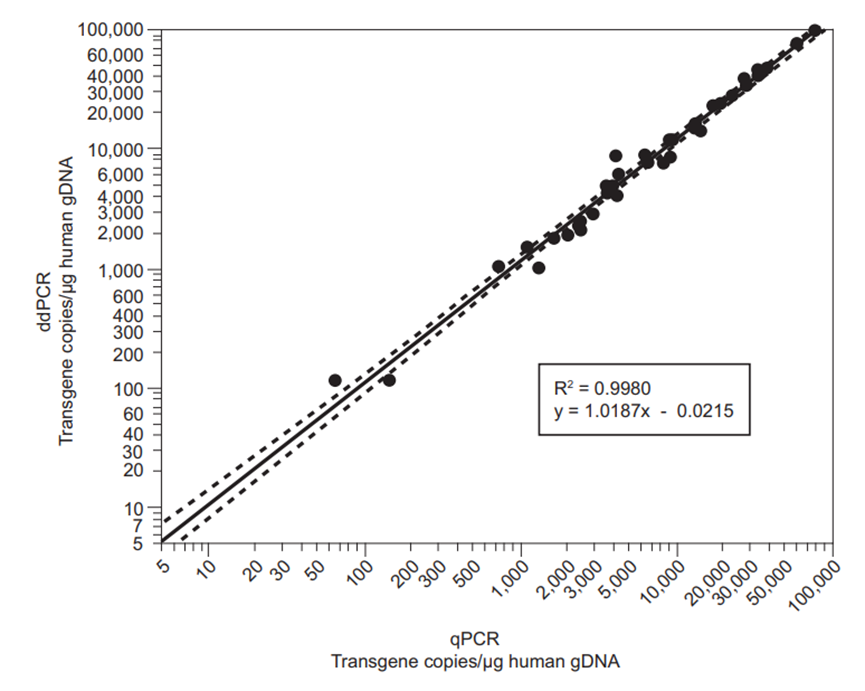
图5 Kymriah®基于qPCR与ddPCR的准确度评估
线性和动态范围(Linearity and dynamic range)
Kymriah® DNA标准品与CDKN1A DNA标准品在同一分析批平行进行qPCR检测,重复3个分析批,Kymriah® DNA标准曲线如图6A, 检测结果与DNA标准品用量呈高度线性相关性,确定动态范围为10~1,000,000 copies/200 ng gDNA。由平均线性拟合曲线的平均斜率计算出平均扩增效率为97.36%±1.02%。同样CDKN1A的R2、斜率和扩增效率满足接受标准(图6B)。
变异性(Variability)
通过将正常供者的8份血液样品(WB)、1份骨髓样品(BM)、1份脑脊液(CSF)和3份石蜡切片组织(FFPET)掺入不同含量的CAR质粒DNA,进行批内和批间变异性的测定。试验共进行三个分析批,每个样品一式三份重复。批内、批间变异性结果如表6。
小结
通过GCC对于qPCR/ddPCR技术验证项的推荐和接受标准,并结合Kymriah®验证实例分析,有助于方法开发者对CGT产品进行方案设计。监管机构推荐可应用qPCR法定量外源基因拷贝数来检测并评估对应指标。qPCR/ddPCR技术应用于CGT产品的生物分析可以快速、准确地提供有关基因扩增与生物分布、药代(细胞)动力学、药效学、生物标志物等基因组、转录组、表观遗传组水平的信息。尽管qPCR在临床/临床前环境中得到十分广泛的应用,尤其是CAR-T细胞疗法,但qPCR技术在CAR-T的生物分析时也面临不少挑战,例如,CAR-T细胞表达取决于多种因素,例如启动子类型、启动子特异性、表观遗传修饰等。虽然qPCR 灵敏度足够高,但在长期随访的监测中,基于qPCR得到的定量结果由于无法区分细胞是否表达功能性CAR蛋白,可能会高估体内功能性CAR-T细胞的“有效”数量。一般在进行CAR-T细胞的药代(细胞)动力学分析时,监管机构推荐采用qPCR与流式细胞技术相结合的方式进行评估,通过基因水平和蛋白水平相互比较,两种方法优势互补。
生物分析科学家应深入了解基于qPCR/ddPCR技术开发方法背后的科学机理,制定可靠的生物分析方案、评估对研究具有潜在影响的因素,确保在方法开发验证期间能够顺利进行。应依据实际检测条件、产品自身特性、样本类型等进行生物分析开发方法的评估。当CGT产品进入临床试验阶段时,应遵循GPL要求进行规范的方法学验证和临床样本检测。CGT产品临床试验的生物分析内容原则上包括药代动力学分析、药效学分析、免疫原性分析、生物标志物分析等。根据CGT产品特性,可酌情调整相应的qPCR验证项与接受标准的设计,以满足当前的实际检测条件和要求。
总之,CGT产品与其它生物大分子药物或传统小分子药物的生物分析之间存在一定的共性,并对部分方法开发和验证内容进行了适当地参考和应用,但CGT产品的独特特性也增加了生物分析的挑战性,尤其是开发基于qPCR/ddPCR技术的分析方法时,诸如分析灵敏度、动态范围、准确度、特异性、选择性等关键验证项是值得探究的。此外,应当注意的是,全球主要监管机构(如中国NMPA、美国FDA、欧盟EMA等)对于CGT产品的qPCR/ddPCR技术方法开发验证的要求也存在一定程度上的差异,在IND或NDA阶段申报不同国家或地区时,适应性地依据法规和指南要求进行方法开发与验证调整,来满足监管机构对相关生物分析的临床检测要求。
参考文献(References)
Mark Wissel, Martin Poirier, Christina Satterwhite, et al. Recommendations on qPCR/ddPCR assay validation by GCC[J]. Bioanalysis. 2022; 14(12):853-863.
Lisa Davis, Nathan Riccitelli, Nancy Valencia, et al. Monitoring of tisagenlecleucel transgene DNA using a quantitative polymerase chain reaction assay[J]. Mol Ther Methods Clin Dev. 2020; 20:535-541.
Michael Boettcher, Alexander Joechner, Ziduo Li, et al. Development of CAR T cell therapy in children-a comprehensive overview[J]. J Clin Med. 2022; 11(8):2158.
FDA. Package Insert-KYMRIAH[R]. FDA. 2022. STN: 125646.
F·贝多亚, H·比特, J·布罗格顿, et al. 预测针对嵌合抗原受体疗法的治疗应答性的生物标志及其用途[P]. 中国专利: CN 201580065528.
版权说明:本文来自康维讯内容微信团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。申请转载授权请给微信公众号后台留言或发送消息,并注明转载名称及ID。本文来自康维讯内容微信团队,欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责声明:本文仅供信息交流及一般参考之用,文中观点不代表康维讯立场,亦不代表康维讯支持或反对文中观点。本文不可直接作为决策内容,康维讯不对任何主体因使用本文内容而导致的任何损失承担责任。
关于康维讯生物
康维讯生物由经验丰富的生物分析专家团队领衔成立,提供全方位、一站式的生物分析服务,涵盖临床前/临床药代动力学、药效学、免疫原性、生物标志物,中心实验室样本管理;以及高端分析仪器、高值耗材、试剂研发销售等业务。公司已建成免疫检测分析平台、分子检测分析平台以及细胞学分析平台等技术平台,并在温州设有高端分析仪器、高值耗材和试剂的CRI研发中心,在苏州吴中生物医药产业园设有3,000平米GLP检测服务实验室,包括适合CGT和ADC产品生物分析的十万级净化实验室,BSL-2级实验室,PCR分析实验室,配备生物分析专业管理系统和高端/专业检测仪器,实验室GLP质量体系可同时满足全球监管机构的申报要求。
康维讯生物团队累积了多年的生物分析经验,将坚持“推动生物行业发展,助力新药研发”的使命,以助力创新型药物上市为己任,致力于成为全球药企生物分析最值得信赖的合作伙伴。康维讯生物以创新技术为基石,一方面提供质高价优、符合全球监管机构要求的生物分析服务,助力药物研发企业降低研发成本,提高申报成功率,加速申报进程;另一方面研发并提供高端分析仪器和高值耗材试剂产品,助力分析行业构建低成本的产业链生态,并进一步打造高度自动化、高灵敏度的分析检测能力。康维讯生物已经开发出助力生物分析实验室自动化的板式自动化操作平台和支持细胞治疗产品研发的细胞分选仪。康维讯生物肩负两大业务版图为双轮驱动,以塑造成生物分析CRO领域的国际化品牌与形象。 更多信息,请访问康维讯生物官方网站:
www.kanwhish.com
Please tell us your questions or needs
and Kanwhish Biotech will contact you as soon as possible via email or phone.

 © 2022-2025 Copyright All Rights Reserved. 苏ICP备2023013734号-1
© 2022-2025 Copyright All Rights Reserved. 苏ICP备2023013734号-1