Overview of Bioanalysis of Cell Therapy Products
细胞与基因治疗产品概述 细胞与基因治疗(Cell and Gene Therapy, CGT)按产品形式可主要分为体外(Ex vivo)基因治疗和体内(In vivo)基因治疗。一般来说,体外基因治疗主要涉及基因改造的细胞疗法(Cell therapy),指获取患者的目的细胞后,在体外经过基因修饰技术(如调节、替换、添加或删除基因等)以改造其生物学特性,再回输至患者体内用于治疗人类疾病的活细胞治疗方式;体内基因治疗则主要指传统的或狭义的基因疗法(Gene therapy),是将治疗产品直接注射至患者体内,在基因水平上干预基因表达、修正的治疗方式。体外(细胞)基因治疗产品在临床应用中主要涉及免疫细胞基因治疗产品、干细胞基因治疗产品和其它细胞基因治疗产品;而体内基因治疗主要包括病毒载体基因治疗、脂质载体基因治疗和核酸基因治疗。不过,体内基因治疗产品将不在本推文的论述范畴,可以参考康维讯Kanwhish公众号中的其它相关推文。 免疫细胞基因治疗是通过采集患者自体或同种异体的免疫细胞,经过体外培养并进行基因修饰和改造,使其具有靶向杀伤能力,再回输至患者体内,通过直接靶向杀伤目标细胞、调节免疫系统、减弱免疫耐受、激活免疫响应等方式进行干预和治疗。根据采用不同免疫细胞、基因工程改造特点,免疫细胞基因治疗的主要分类为CAR-T、CAR-NK、T细胞受体基因工程改造的T细胞(T cell receptor - engineered T-cell, TCR-T)等方式。不过,对于未经基因改造的细胞疗法诸如肿瘤浸润淋巴细胞(Tumor - infiltrating lymphocytes, TILs)、细胞因子诱导的杀伤细胞(Cytokine - induced killer cells, CIK)等不属于免疫细胞基因治疗。发展最为成熟的免疫细胞基因治疗是针对淋巴瘤的anti-CD19和anti-BCMA CAR-T细胞疗法,目前已有多款CAR-T产品获得中国NMPA、美国FDA、或欧盟EMA等监管局批准上市,还有一款是同种异体T淋巴细胞自杀基因免疫疗法的Zalmoxis®(已退市),用于辅助治疗造血干细胞移植后的移植物抗宿主病。 干细胞具有自我更新、多向分化潜能、良好组织相容性的特性,可作为基因治疗药物的细胞载体,在再生医学领域和CGT领域具有广阔的应用前景。人源干细胞及其衍生细胞的基因治疗产品涉及人源自体或同种异体干细胞,经体外操作(包括提取、分离、纯化、培养、扩增、基因编辑/基因修饰、诱导分化、冻存及复苏、运输等一系列过程)形成临床试验的产品制剂,对干细胞的错误基因进行编辑和修正后再回输(植入)至患者体内,可用于遗传性疾病的干预和治疗。干细胞基因治疗产品不仅具有细胞治疗产品的特点还兼具基因治疗产品的特性,对临床试验设计要求更高,但现阶段临床数据多是单中心、小样本、罕见疾病,对该类治疗产品的开发以及其相关的安全性、有效性带来诸多挑战。因此,科学、充分的生物分析能够保障干细胞基因治疗产品在临床试验阶段顺利进行,是不可或缺的重要组成部分。干细胞基因治疗主要集中在罕见病和神经退行性疾病,在欧美地区获批上市的干细胞基因治疗产品包括用于治疗腺苷脱氨酶严重联合免疫缺陷症的Strimvelis®、治疗输血依赖性β-地中海贫血的Zynteglo®、治疗早期脑型肾上腺脑白质营养不良的Skysona®以及治疗早发性异染性脑白质营养不良的Libmeldy®。
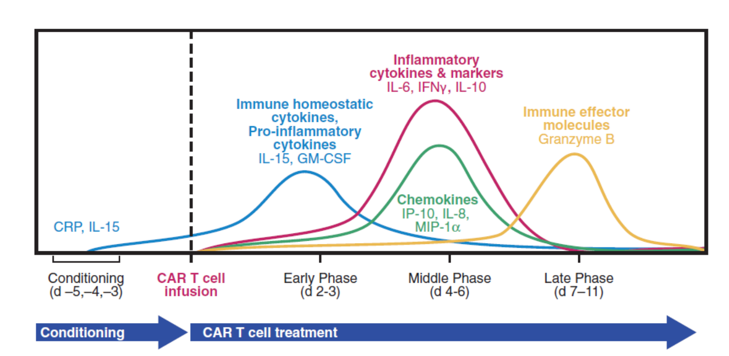
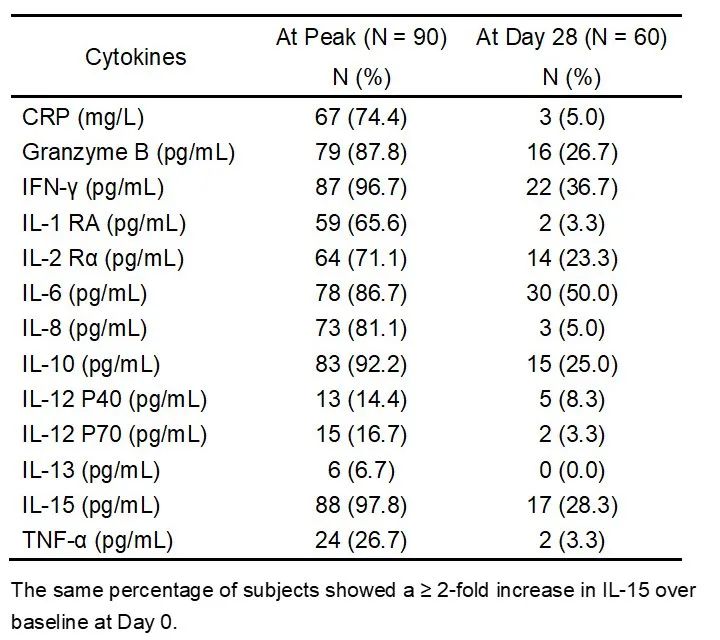
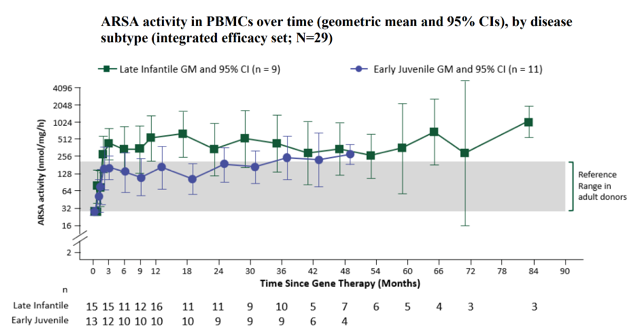
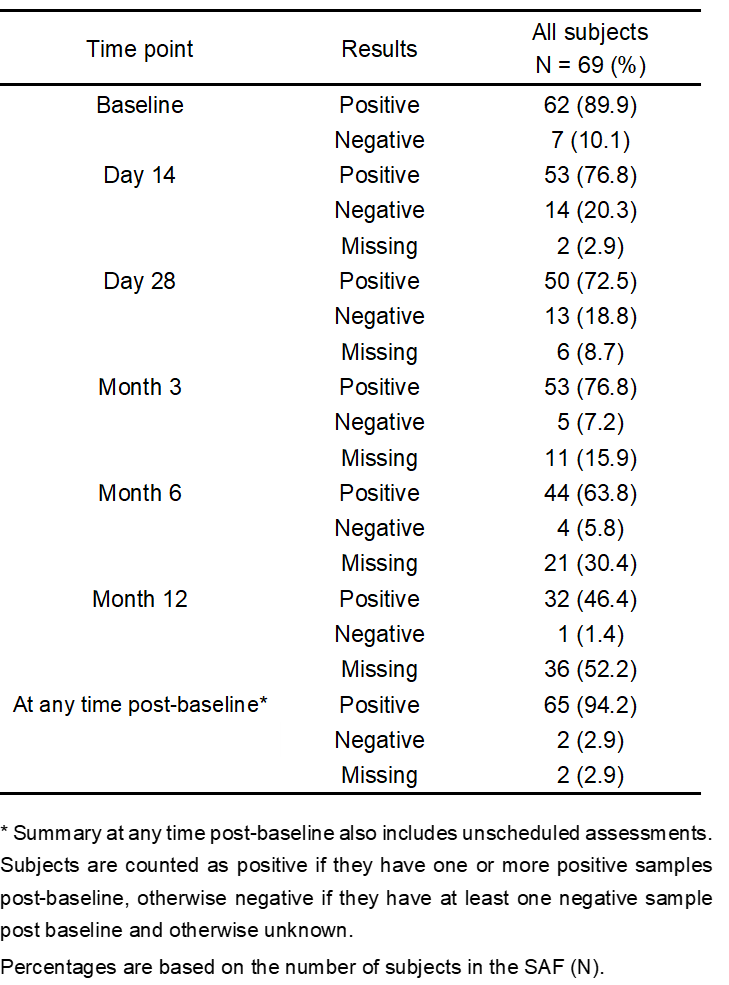
细胞治疗产品的生物分析 在CGT产品进入体内后,细胞可能分化成预期和非预期的多种细胞类型、互相之间进行转换,尤其是由多种细胞亚群混合的治疗产品,也可能发展至其它作用机制(MOA)的治疗功能。另一方面,细胞产品由循环系统递送全身可能导致细胞分布到各个组织,即使移植至目标组织区域(如骨髓)也可能产生非预期的迁移,因此需要对细胞产品的生物分布、归巢和追踪监测进行研究。当CGT产品整合至基因组时可能发生不受控的基因编辑(基因突变),导致关键基因的激活或失活,进而诱发癌变的发生。CGT产品既有细胞治疗产品的特点,也有基因治疗产品的潜在风险,临床试验的生物分析则是CGT产品研发的重要内容之一,因为充分的临床生物分析能够: 阐明CGT产品在人体内的药代(细胞)动力学特征,为给药途径、给药剂量等选择提供支持性证据; 确认CGT产品的MOA,基因修饰的目的、功能,以及转基因蛋白的表达水平,明确CGT产品的治疗效果和治疗机理; 根据潜在的生物风险因素,预测人体给药后的一系列免疫反应特征,确认不良免疫反应(适应性免疫和固有免疫)的临床监测指标,为制定临床风险控制措施提供参考依据。 因此,建议开展充分的生物分析研究,收集用于评估的数据和信息,以确立所开发的CGT产品在生物分析角度具有合理的、可接受的获益风险比,为临床试验设计和风险控制策略提供证据支持。 药代(细胞)动力学分析 CGT产品的药代动力学(细胞动力学)特征与传统小分子药物或大分子生物药有明显的区别,大多数CGT产品难以通过传统的吸收、分布、代谢和排泄(ADME)等分类方式进行药代动力学评估。CGT产品的药代动力学研究应能阐明细胞产品在体内的生物学过程以及伴随的生物学行为,根据细胞治疗产品类型和特点(尤其是免疫细胞基因治疗与干细胞基因治疗)、研究目的及检测指标的临床价值,建立合理的生物分析方法并对方法进行必要的验证。药代动力学研究应主要关注目标细胞进入体内后的数量变化、监测细胞活力/表型分化(例如细胞表型和功能标志物)、持续时间(例如血药浓度-时间曲线下面积、达峰浓度、达峰时间等特征常数)、预期存活期内的功能(或替代标志物)、体内生物分布、异位灶、组织嗜性/迁移、生物分子的表达和/或分泌、以及与宿主组织的相互作用关系等特征;有时,相互作用还可以包括细胞治疗产品的非细胞成分以及分泌的生物活性分子引起的相关组织反应。 CGT产品的药代动力学检测通常建议在方法开发阶段采用多种检测方式评估并监测目标细胞在体内的情况,由于免疫细胞基因治疗和干细胞基因治疗是经过基因工程技术修饰过的产品,可以同时采用荧光定量PCR(qPCR)和流式细胞术(Flow cytometry)进行分析,这两种技术手段分别测定外源基因拷贝数和目标表型阳性(如CAR+、外源基因+)的细胞数量变化,可以更全面的分析细胞治疗产品在体内的扩增和存活情况。在设计药代动力学检测方法和相互验证时,可以将PCR法检测结果理解为产品在机体内的“总数”,而流式细胞术的检测结果则更偏向于“有效数”(图2)。广泛应用的PCR法包括qPCR和数字PCR(dPCR),用于监测体内转基因的拷贝数。首先根据转导的外源基因序列设计高度特异性的引物和探针(通常设计的区域可位于scFv、两段基因的交界处等)、制备基因组DNA标准品、选择适宜的内参基因(如ACTIN、CDKN1A),以及根据qPCR的反应效率和gDNA量进行因子修正,最终在受试者血液样品中确定单位gDNA的CAR转基因拷贝数。为了评估qPCR法在CAR-T细胞中的分析灵敏度和重复性,可应用数字PCR技术对CAR拷贝数进行绝对定量,并将结果作为qPCR检测方法的参考拷贝数。数字PCR技术还能增加罕见事件的检测机率并减少检测的变异性,当采样的时间足够长会导致目标分析物的丰度变得很低,进而需要灵敏度极高的分析方法时,可考虑开发基于数字PCR的分析方法。对于基于流式细胞术的方法开发和验证阶段首要考虑的是构建适用的标准阳性细胞样品,理想阳性对照品则是细胞治疗产品本身,但实际情况大多难以实现,因此构建阳性细胞标准品的目标则是最大程度接近预期用途样品。此外,关键试剂的选择和制备、方法灵敏度优化也是前期在产品开发阶段值得关注的重点。例如CAR-T细胞产品可通过对CAR+细胞的测定来表征产品的药代动力学特征,尽管在分析灵敏度上有时稍逊色于PCR法,但其反映形式是细胞水平的,更加契合“细胞动力学”的生物学含义,也能同步分析各细胞亚群的动态变化。另外,基于流式细胞术的方法开发无需申办方提供核心的CAR序列信息,这是一条显著的优势。 图2 药代动力学(细胞动力学)检测方法的比较 Kymriah®(Tisagenlecleucel)是一款抗CD19 自体CAR-T 免疫细胞基因治疗,通过识别CD19靶向结合恶性肿瘤细胞,CAR传递信号促进CAR-T细胞激活增殖、清除靶细胞和保持持久性。以流式细胞术检测得到的药代动力学(细胞动力学)表现为治疗早期短暂下降,随后CAR-T细胞通过与CD19靶点结合得到激活并增殖,在28天内达到峰值并维持较高水平,后面CAR-T细胞群因耗损呈一定的下降趋势,但能保持长期存在。qPCR分析得到的结果与此类似,但检测到的信号更为持久。通过qPCR和流式细胞术两种方法比较CAR-T细胞检测结果,qPCR检测灵敏度相较于流式细胞术更高。 尽管大多数在欧盟EMA获批上市的干细胞基因治疗产品尚未描述其产品的药代动力学特征,但在早期设计临床试验方案时,应尽可能开展针对干细胞基因治疗产品的体内过程研究。根据研究要求、可能采取的检测方法及可行性进行评估,以初步判断干细胞产品在血液中随时间的变化规律,预期细胞存活周期,细胞增殖分化、生物分布和归巢能力。qPCR法可设计针对产品编辑基因直接进行特异性扩增和检测;而流式细胞术则需检测特定表型的细胞数量以进行表征,如果干细胞基因治疗产品在体内是独特的(例如,患者具有某种缺失或突变的蛋白,而治疗产品产生该蛋白),就能直接表征其药代动力学特征;如果通过流式细胞术无法区分治疗产品和内源细胞,则评估目标细胞整体的动态规律。 药效学分析 药效学研究应采用可靠的检测方法来验证细胞治疗产品的基本治疗机理,临床试验设计应考虑细胞治疗产品的MOA、疾病周期长度以及给药方式等因素,结合细胞治疗产品自身特性和细胞在机体的存活时间。 对于大多数免疫细胞基因治疗产品,可以通过细胞和/或体液免疫应答分析药效学活性。当治疗产品有一个或多个特异性靶点时,应分析其对每个靶点的作用活性。如果产品具有分泌特定蛋白、多肽或其它活性成分、亦或是敲除基因的,也需要进行针对性药效学分析,如检测特定蛋白的活性、持续时间和变化情况等。免疫细胞基因治疗产品可能在体内存活较长时间,并产生长期疗效,确证性试验的临床考察点还应关注疗效的持续时间。由于临床试验的持续时间和受试者数量受限,以及免疫细胞基因治疗产品尚缺乏大规模临床应用经验,上市后通过收集真实世界数据,有助于进一步考察产品的长期疗效。美国FDA发布的CAR-T细胞产品开发指导原则《Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products》的VI.-C.-2.节建议:药效学评估指标包括效应细胞因子、免疫分型和肿瘤细胞杀伤的变化水平(MRD)。药效学方案的设计要能反映标志物的效应特点和预期反应持续时间,且探索性的相关分析涉及CAR-T细胞产品的效应与药代动力学特征间的关系,并结合CAR-T细胞暴露量与药物效应进行分析(图3和表1)。 图3 免疫细胞基因治疗的药效学标志物的动态变化 表1 免疫细胞基因治疗产品的药效学生物分析 Yescarta®是一款抗CD19自体CAR-T免疫细胞基因治疗产品。分析相关细胞因子(包括CRP、Granzyme B、IFN-γ、TNF-α、IL家族)的表达水平,在峰值和Day 28通过比较高于基线2倍的患者比例来评估CAR-T细胞产品的药效学。 干细胞基因治疗产品具有自我复制和多向分化潜能,它们在体内的存活和作用持续时间相较于免疫细胞基因治疗产品更长,体内药效学的研究方法成熟度不如传统药物成熟、甚至不如免疫细胞基因治疗产品。接受干细胞基因治疗的受试者可能终身伴随该类细胞产品,如果细胞产品因非预期地增殖而过表达,将导致基因表达产物的毒性蓄积。应根据外源基因的表达情况和功能活性设计药效学生物分析策略,可考虑检测的PD生物分析目标物包括: 外源基因的水平和持续时间; 基因表达产物的暴露量和生物分布; 基因表达产物的功能活性/酶活性水平; 细胞表面标志物的分型和比例。 应当注意的是,鉴于细胞治疗产品种类繁多、各有特点,具体选择哪类生物分析目标物应当合理地结合干细胞基因治疗产品本身特性以及主要研究者的决策,更好地表征细胞治疗产品药物效应动力学的量效关系,充分解释预期或非预期的临床试验结果(图4)。 图4 干细胞基因治疗产品的药效学生物分析 Libmeldy®是一款自体CD34+ HSPC干细胞基因治疗,利用慢病毒载体转导ARSA基因至自体CD34+ HSPCs基因组中,使干细胞能够表达功能性ARSA,用于治疗早发性异染性脑白质营养不良。经Libmeldy®治疗后检测ARSA的功能活性水平(ARSA activity),在给药后3个月达到正常生理水平,并在整个随访期中患者稳定保持或高于正常参考范围(灰色区域)。注:ARSA(Arylsulfatase A),芳基硫酸酯酶A。 而其它类型细胞的基因治疗产品如果是用于修复/免疫调节/替换细胞/组织,并有望能够终生发挥功能,除了上述研究内容可考虑纳入外,相关的结构/组织学检测指标也可作为潜在的药效学标志物进行检测,包括镜检、组织学检测(IHC、IF)、成像技术(MRI、B超、X射线)或酶活性指标检测等。 免疫原性分析 体液免疫反应 对于CGT产品,诱导机体产生免疫反应的主要因素包括:(1)转基因的外源产物蛋白(例如CAR基因表达蛋白、缺陷修正的转基因表达蛋白等);(2)同种异体细胞(通用型CAR-T细胞)。免疫反应主要由固有免疫反应、适应性体液免疫和细胞免疫反应,体液免疫反应由B淋巴细胞驱动产生针对外源CAR蛋白或CAR-T细胞的抗体,即抗药抗体(ADA)和中和抗体(NAb)。外源CAR蛋白是基因工程化的非天然产物,CAR结构中的scFv和胞内胞外蛋白拼接结构是诱导机体产生体液免疫反应的主要因素,部分CAR-T细胞产品的scFv甚至是鼠源序列,其免疫原性风险可能更高。这些由体液免疫反应产生的ADA可能减弱或阻碍细胞产品的生物学功能,进而降低细胞产品的有效性,甚至引发非预期的不良反应、增加治疗安全性风险。配体结合测定法(Ligand binding assay, LBA)和基于细胞的检测方法(Cell Based Assay, CBA)常用于CAR-T细胞的免疫原性测定。若CAR-T产品是自体产品,传统的LBA(如ELISA)可用于评估CAR胞外结构域的ADA,但是,重组表达的游离CAR蛋白是无法完全表征CAR-T细胞在生理状态下的胞外结构,该方法可能对细胞免疫原性的评估缺乏足够的敏感性和准确性。不过,它的优势在于方法学开发和验证过程相对简单,整体开发时间往往较短,更适合早期的探索性临床研究。流式细胞术是免疫原性检测的首选方案,它不仅可以评估ADA的水平、也可以用于评估预存抗体的存在,而且对同种异体(通用型)CAR-T细胞产品,流式细胞术也能够评估因同种异体发生的体液免疫反应(表2)。流式细胞术方法开发的难点在于:(1)预期用途的标准品细胞数量非常有限,很难建立受试者特异性的检测方法,因此基于稳转细胞系(CHO、Jurkat等)或转导CAR-T的健康供体T细胞可考虑作为标准细胞样品;(2)ADA阳性对照抗体的制备开发与优化验证也是挑战之一,需要制备并应用人源的ADA阳性对照抗体,以避免ADA样本与阳性对照抗体的物种差异;(3)CAR-T预存抗体是确定Cut point的干扰因素,应谨慎处理,以避免检测临床样本时发生假阳性误判。 表2 免疫原性生物分析 — 体液免疫 Kymriah®(Tisagenlecleucel)对体液免疫原性的评估,使用流式细胞术检测受试者血清中与Kymriah®结合的anti-MCAR19抗体。人血清样品中的anti-MCAR19抗体由转染MCAR19的Jurkat细胞系捕获,未转染的Jurkat细胞作为对照品,并检测细胞所有结合的IgG/M(anti-MCAR19抗体)。基线显示89.9%(62/69)受试者显示出预存抗体,在治疗后任意时间节点出现检测结果阳性的患者比例达到94.2%(65/69)。 细胞免疫 接受CAR-T细胞治疗时,CAR-T细胞自身可能诱发细胞免疫应答而产生针对CAR-T细胞的细胞毒性攻击。CAR-T细胞能够通过MHC I型分子递呈外源重组的CAR结构,并被细胞毒性CD8+ T细胞识别,活化的CD8+ T细胞针对CAR-T细胞进行靶向攻击并裂解,导致CAR-T细胞数量减少,进而导致疗效下降。在临床试验阶段,监测细胞免疫反应是安全性评估的另一项重要生物分析。细胞免疫原性也可以通过多种检测方法进行评估和监测,最常用、最成熟的方法之一是ELISpot(Enzyme-linked ImmunoSpot Assay)。完整的CAR-T氨基酸序列用于构建重叠短肽的肽库,这些多肽将被添加至受试者PBMCs中,如果受试者的PBMCs样品存在能够识别某个多肽段并产生反应性的T细胞,这些T细胞将分泌一系列的炎症细胞因子,如IFN-γ,将在ELISpot上读出一个单细胞阳性斑点。ELISpot也可以作为细胞毒性试验的检测方法,用于评估针对CAR靶细胞的细胞毒性裂解能力。此外,流式细胞术也能够用于检测细胞免疫原性,使用CAR-T衍生的系列多肽刺激PBMCs,通过胞内炎症细胞因子染色技术评估产生的细胞因子水平。 尽管CAR-T细胞疗法已在临床经过验证,但我们并不完全了解免疫原性对免疫细胞基因治疗产品所带来的潜在影响,全面地评估免疫原性并构建合理的生物分析检测方法是至关重要的,这些临床检测数据将在免疫细胞基因治疗的整体疗效和安全性评估上发挥关键作用。 生物标志物分析 CGT产品的生物标志物可以包括:诊断性、预测性、预后性、监测性、安全性等生物标志物。早期探索性临床试验可以通过二代测序(NGS)的方法评估受试者基线组织的基因表达与突变特征、利用生化分析仪检测基线的血清生物标志物、或者设计检测靶点表达情况以表征诊断性生物标志物。不过,生物标志物并没有绝对的界限与分类,主要研究者可依据CGT产品的特性和生物分析经验,自主设计探索性研究内容。例如,通过多色流式细胞术检测血液样品中免疫细胞/干细胞分化亚群的特征,利用免疫组织化学(IHC)或者多重荧光免疫组织化学(mIHC)的方法来评估目标生物标志物在组织中的表达和分布情况,对于免疫细胞基因治疗产品可以考虑免疫检查点(如PD-L1,LAG-3,TIM-3等)和肿瘤/免疫微环境的评估。 免疫细胞基因治疗主要的不良反应涉及细胞因子释放综合征(CRS)和神经毒性(ICANS),受试者体内细胞因子可能由治疗骤然升高,而严重的神经毒性可能导致受试者认知障碍。对这些不良反应的早期干预调控、全程监测、后续长期随访十分重要,甚至能够影响免疫细胞基因治疗的效果。申办方应对受试者的基线和预定的时间节点监测这些细胞因子的水平,以便实时掌握细胞因子释放的动态变化情况。在临床试验开展前提供检测细胞因子的生物分析方法,这需要定制化设计并检测多种细胞因子,包括炎症相关因子、生长因子等,以便更好地阐明细胞产品的作用机制和药效关系。在制定所需检测的生物标志物panel时,可参考同类上市或临床阶段竞品的设计方案、已披露的临床试验结果,结合自身产品的特性和本次临床试验需要考察的目的和意义,合理地制定生物标志物分析对象。尤其,细胞因子的检测是高度可变的,随着临床试验I/II/III期的推进以及各生物分析数据的积累,主要研究者需要灵活地、准确地判断和优化生物标志物检测方案,尤其早期临床试验的生物标志物检测结果可能直接作为后续研究方向的重要依据。其多因子分析的难点在于各类细胞因子的动态范围差异较大,需要的生物分析方法要具备足够的分析灵敏度以及足够宽的检测动态范围,才能保证在检测和分析时能够涵盖目标分析物。常用的细胞因子生物分析平台如ELISA、MSD、Luminex、Simoa,在检测细胞因子上有各自的优缺点,应谨慎选择。 医学专业名词对照表(Glossary) 参考文献(References) Rakesh Awasthi, Lida Pacaud, Edward Waldron, et al. Tisagenlecleucel cellular kinetics, dose, and immunogenicity in relation to clinical factors in relapsed/refractory DLBCL[J]. Blood Adv. 2020; 4(3):560-572. EMA. Assessment report, YESCARTA, International non-proprietary name: axicabtagene ciloleucel (EMA/481168/2018)[R]. Committee for Medicinal Products for Human Use (CHMP). 2018; Procedure No. EMEA/H/C/004480/0000. EMA. Libmeldy: EPAR - Product information[R]. European Medicines Agency. 2022; EMEA/H/C/005321 - IB/0009. EMA. Assessment report for paediatric studies submitted according to Article 46 of the Regulation (EC) No 1901/2006, Kymriah, tisagenlecleucel (EMA/104600/2022)[R]. Human Medicines Division. 2022; Procedure no: EMEA/H/C/004090/P46/012.1. 指导原则(Guidance) 《细胞治疗产品研究与评价技术指导原则》,NMPA, 2017. 《免疫细胞治疗产品临床试验技术指导原则》,NMPA, 2021. 《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则》,NMPA, 2020. 《基因修饰细胞治疗产品非临床研究技术指导原则》,NMPA, 2021. 《免疫细胞治疗产品药学研究与评价技术指导原则》,NMPA, 2020. 《Guideline on quality, non-clinical and clinical aspects of medicinal products containing genetically modified cells》,EMA, 2020. EMA/CAT/GTWP/671639/2008 《Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products》,FDA, 2020. 关于康维讯生物 康维讯生物由经验丰富的生物分析专家团队领衔成立,提供全方位、一站式的生物分析服务,涵盖临床前/临床药代动力学、药效学、免疫原性、生物标志物、生物活性分析、中心实验室样本管理;以及高端分析仪器、高值耗材、试剂研发销售等业务。公司已建成免疫检测分析平台、分子检测分析平台以及细胞学分析平台等技术平台,并在温州设有高端分析仪器、高值耗材和试剂的CRI研发中心,在苏州吴中生物医药产业园设有3,000平米GLP检测服务实验室,包括适合CGT和ADC产品生物分析的十万级净化实验室,BSL-2级实验室,PCR分析实验室,配备生物分析专业管理系统和高端/专业检测仪器,实验室GLP质量体系可同时满足全球监管机构的申报要求。 康维讯生物团队累积了多年的生物分析经验,将坚持“推动生物行业发展,助力新药研发”的使命,以助力创新型药物上市为己任,致力于成为全球药企生物分析最值得信赖的合作伙伴。康维讯生物以创新技术为基石,一方面提供质高价优、符合全球监管机构要求的生物分析服务,助力药物研发企业降低研发成本,提高申报成功率,加速申报进程;另一方面研发并提供高端分析仪器和高值耗材试剂产品,助力分析行业构建低成本的产业链生态,并进一步打造高度自动化、高灵敏度的分析检测能力。康维讯生物已经开发出助力生物分析实验室自动化的板式自动化操作平台和支持细胞治疗产品研发的细胞分选仪。康维讯生物肩负两大业务版图为双轮驱动,以塑造成生物分析CRO领域的国际化品牌与形象。 更多信息,请访问康维讯生物官方网站: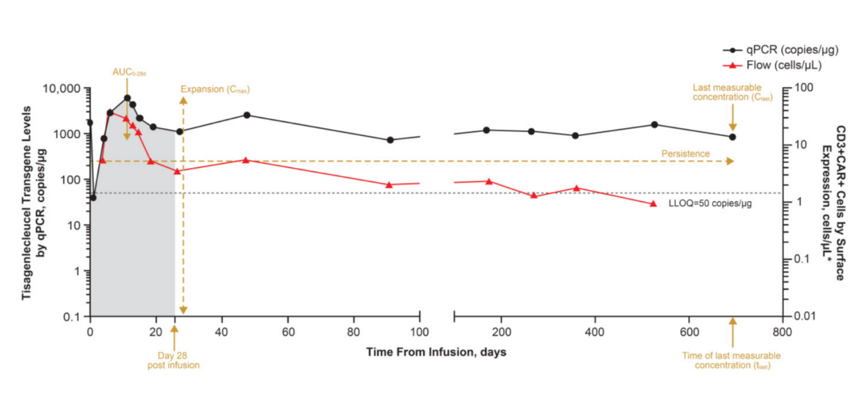
www.kanwhish.com
Please tell us your questions or needs
and Kanwhish Biotech will contact you as soon as possible via email or phone.

 © 2022-2025 Copyright All Rights Reserved. 苏ICP备2023013734号-1
© 2022-2025 Copyright All Rights Reserved. 苏ICP备2023013734号-1